 电话:021-69515711
电话:021-69515711 手机:13818065015
手机:13818065015 传真:021-69515712
传真:021-69515712-

 1049485
1049485
-

 8459743
8459743
-

 1993509414
1993509414

 :renrimarket
:renrimarket 
 market@renri.com.cn
market@renri.com.cn

 REN510型便携式γ谱仪主要用于安检、反恐、核事故现场的污染分析,可进行γ辐射剂量的测量,同时系统内置核素库,可以自动识别人工及天然同位素。仪器为一体式,内置2英寸NaI(Tl) γ探测器,可同时测量γ能谱、γ剂量率。仪器为全数字化,集探测器、成型放大器、多道分析器、电源、触摸屏、内存为一体,功耗
REN510型便携式γ谱仪主要用于安检、反恐、核事故现场的污染分析,可进行γ辐射剂量的测量,同时系统内置核素库,可以自动识别人工及天然同位素。仪器为一体式,内置2英寸NaI(Tl) γ探测器,可同时测量γ能谱、γ剂量率。仪器为全数字化,集探测器、成型放大器、多道分析器、电源、触摸屏、内存为一体,功耗 REN500E辐射剂量率仪是以内置高灵敏度盖格计数管为探测器,测量χ、γ和硬β辐射的多功能便携式剂量率仪。作为辐射巡测仪,能显示工作场所的剂量当量率和累积剂量,自动连续测量和记录1600条辐射剂量率数据,更换电池时,日历、时间及检测数据能永久保存。工
REN500E辐射剂量率仪是以内置高灵敏度盖格计数管为探测器,测量χ、γ和硬β辐射的多功能便携式剂量率仪。作为辐射巡测仪,能显示工作场所的剂量当量率和累积剂量,自动连续测量和记录1600条辐射剂量率数据,更换电池时,日历、时间及检测数据能永久保存。工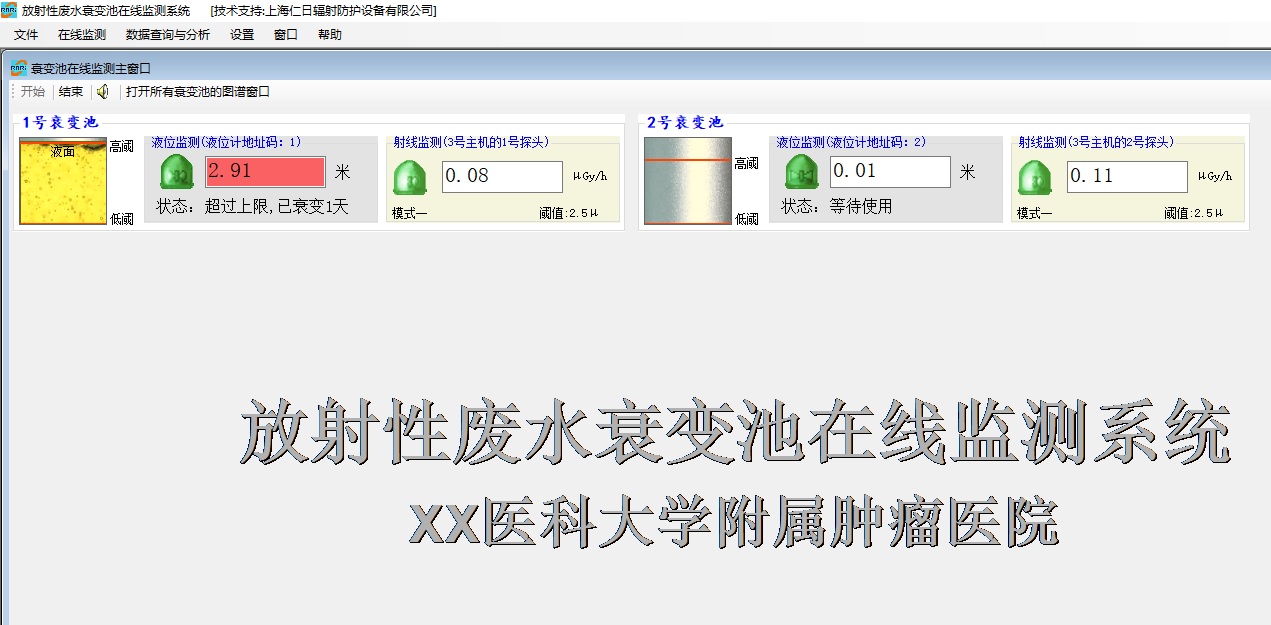 为了加强对放射性废液排放的监督管理,保障人体健康,保护环境,根据《中华人民共和国放射性污染防治法》《电离辐射防护与辐射源安全基本标准》《 医用放射性废物的卫生防护管理》等相关法规与标准的要求,考虑人为操作失误及放射性废液错误排放后可能引发的严重环境危
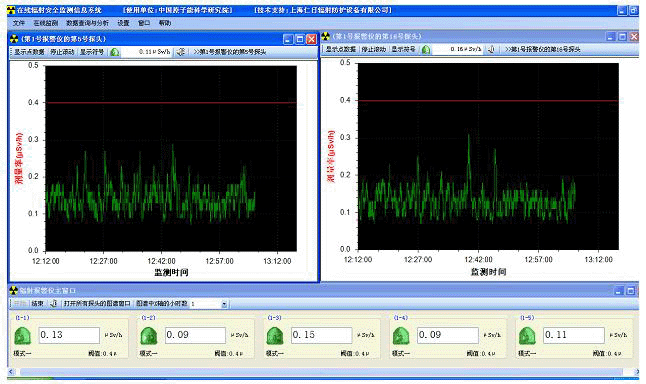
为了加强对放射性废液排放的监督管理,保障人体健康,保护环境,根据《中华人民共和国放射性污染防治法》《电离辐射防护与辐射源安全基本标准》《 医用放射性废物的卫生防护管理》等相关法规与标准的要求,考虑人为操作失误及放射性废液错误排放后可能引发的严重环境危 REN300A在线辐射安全报警仪是一种新型的x-γ辐射连续监测报警装置,它采用特殊设计的前置放大电路,具有灵敏度高、操作方便、自动显示和超阈值报警等特点,能实时给出xγ辐射剂量率;仪器内置海量数据存储功能,能存储10年的历史数据且标配提供强大的RenLocal辐射监测数据分析软件。考虑
REN300A在线辐射安全报警仪是一种新型的x-γ辐射连续监测报警装置,它采用特殊设计的前置放大电路,具有灵敏度高、操作方便、自动显示和超阈值报警等特点,能实时给出xγ辐射剂量率;仪器内置海量数据存储功能,能存储10年的历史数据且标配提供强大的RenLocal辐射监测数据分析软件。考虑 REN200B型X、γ辐射个人剂量当量HP(10)监测仪(简称:个人剂量报警仪)内置高量程盖格计数管为探测器,主要用来监测各种放射性工作场所的X、γ以及硬β射线的辐射,具有较宽的测量范围。能显示工作场所的剂量当量率和累积剂量,更换电池时,日期及累积数据能永久保存。可选配RenRiPersonal个人
REN200B型X、γ辐射个人剂量当量HP(10)监测仪(简称:个人剂量报警仪)内置高量程盖格计数管为探测器,主要用来监测各种放射性工作场所的X、γ以及硬β射线的辐射,具有较宽的测量范围。能显示工作场所的剂量当量率和累积剂量,更换电池时,日期及累积数据能永久保存。可选配RenRiPersonal个人 REN200A型X、γ辐射个人剂量当量HP(10)监测仪(简称:个人剂量报警仪)内置高灵敏度盖格计数管为探测器,主要用来监测各种放射性工作场所的X、γ以及硬β射线的辐射,具有响应快,测量范围宽的特点。能显示工作场所的剂量当量率和累积剂量,更换电池时,日期及累积数据能永久保存。可选配RenRiPers
REN200A型X、γ辐射个人剂量当量HP(10)监测仪(简称:个人剂量报警仪)内置高灵敏度盖格计数管为探测器,主要用来监测各种放射性工作场所的X、γ以及硬β射线的辐射,具有响应快,测量范围宽的特点。能显示工作场所的剂量当量率和累积剂量,更换电池时,日期及累积数据能永久保存。可选配RenRiPers 颜色:黄白相间,红色文字“当心电离辐射 严禁进入”
材料:涤纶布
规格:4.5cm*100m
特点:电离辐射特有三叶符警示符号和标语
用途:在工业探伤、石油勘探等使用放射源或射线装置的场所中需要隔离划分出监督区和管理
颜色:黄白相间,红色文字“当心电离辐射 严禁进入”
材料:涤纶布
规格:4.5cm*100m
特点:电离辐射特有三叶符警示符号和标语
用途:在工业探伤、石油勘探等使用放射源或射线装置的场所中需要隔离划分出监督区和管理 REN500T是手持式仪表可用来监测X、γ辐射剂量率。用于各种γ辐射场或环境γ辐射的监测工作。仪器配有伸缩长杆,可用于测量人员不易到达或有较强放射性存在的场所,为使用人员提供有效保护。此外通过配套的RenRiRate辐射剂量管理软件可将存
REN500T是手持式仪表可用来监测X、γ辐射剂量率。用于各种γ辐射场或环境γ辐射的监测工作。仪器配有伸缩长杆,可用于测量人员不易到达或有较强放射性存在的场所,为使用人员提供有效保护。此外通过配套的RenRiRate辐射剂量管理软件可将存
放射性药品管理办法
2006/4/16 11:01:00
(中华人民共和国国务院令第208号一九九六年十二月三十日发布)
第一章 总 则
第一条 为了加强放射性药品的管理,根据《中华人民共和国药品管理法》(以下简称《药品管理法》的规定、制定本办法。
第二条 放射性药品是指用于临床诊断或者治疗的放射性核素制剂或者其标记药物。
第三条 凡在中华人民共和国领域内进行放射性药品的研究、生产、经营、运输、使用、检验、监督管理的单位和个人都必须遵守本办法。
第四条 卫生部主管全国放射性药品监督管理工作。能源部主管放射性药品生产、经营管理工作。
第二章 放射性新药的研制、临床研究和审批
第五条 放射性新药是指我国首次生产的放射性药品。药品研制单位的放射性新药年度研制计划,应当报送能源部备案,并报所在地的省、自治区、直辖市卫生行政部门,经卫生行政部门汇总后,报卫生部备案。
第六条 放射性新药的研制内容,包括工艺路线、质量标准、临床前药理及临床研究。研制单位在制订新药工艺路线的同时,必须研究该药的理化性能)纯度(包括核素纯度)及检验方法、药理、毒理、动物药代动力学、放射性比活度、剂量、剂型、稳定性等。
研制单位对放射免疫分析药盒必须进行可测限度、范围、特异性、准确度、精密度、稳定性等方法学的研究。
放射性新药的分类,按新药审批办法的规定办理。
第七条 研制单位研制的放射性新药,在进行临床试验或者验证前,应当向卫生部门提出申请,按新药审批办法的规定报送资料及样品,经卫生部审批同意后,在卫生部指定的医院进行临床研究。
第八条 研制单位在放射性新药临床研究结束后,向卫生部提出申请,经卫生部审核批准,发给新药证书。卫生部在审核批准时,应当征求能源部的意见。
第九条 放射性新药投入生产,需由生产单位或者取得放射性药品生产许可证的研制单位,凭新药证书(副本)向卫生部提出生产该药的申请,井提供样品,由卫生部审核发给批准文号。
第三章 放射性药品的生产、经营和进出曰
第十条 放射性药品生产、经营企业,必须向能源部报送年度生产、经营计划,并抄报卫生部。
第十一条 国家根据需要,对放射性药品实行合理布局,定点生产。申请开办放射性药品生产、经营的企业,应征得能源部的同意后,方可按有关规定办理筹建手续。
第十二条 开办放射性药品生产、经营企业,必须具备《药品管理法》第五条规定的条件,符合国家的放射卫生防护基本标准,并履行环境影响报告的审批手续,经能源部审查同意,卫生部审核批准后,由所在省,自治区、直辖市卫生行政部门发给《放射性药品生产企业许可证》、《放射性药品经营企业许可证》。无许可证的生产、经营企业,一律不准生产、销售放射性药品。
第十三条 《放射性药品生产企业许可证》、《放射性药品经营企业许可证》的有效期为5年,期满前6个月,放射性药品生产、经营企业应当分别向原发证的卫生行政部门重新提出申请,按第十二条审批程序批准后,换发新证。
第十四条 放射性药品生产企业生产已有国家标准的放射性药品,必须经卫生部征求能源部意见后审核批准,并发给批准文号。凡是改变卫生部已批准的生产工艺路线和药品标准的,生产单位必须按原报批程序经卫生部批准后方能生产。
第十五条 放射性药品生产、经营企业,必须配备与生产、经营放射性药品相适应的专业技术人员,具有安全、防护和废气、废物、废水处理等设施,并建立严格的质量管理制度。
第十六条 放射性药品生产、经营企业,必须建立质量检验机构,严格实行生产全过程的质量控制和检验。产品出厂前,须经质量检验。符合国家药品标准的产品方可出厂,不符合标准的产品一律不准出厂。
经卫生部审核批准的含有短半衰期放射性核素的药品,可以边检验边出厂,但发现质量不符合国家药品标准时,该药品的生产企业应当立即停止生产、销售,并立即通知使用单位停止使用,同时报告卫生部和能源部。
第十七条 放射性药品的生产、供销业务由能源部统一管理。放射性药品的生产、经营单位和医疗单位凭省、自治区、直辖市卫生行政部门发给的《放射性药品生产企业许可证》、《放射性药品经营企业许可证》,医疗单位凭省、自治区、直辖市公安、环保和卫生行政部门联合发给的《放射性药品使用许可证》,申请办理订货。
第十八条 放射性药品的进口业务,由对外经济贸易部指定的单位,按照国家有关对外贸易的规定办理。
进出口放射性药品,应当报卫生部审批同意后,方得办理进出口手续。
进口的放射性药品品种,必须符合我国的药品标准或者其他药用要求。
第十九条 进口放射性药品,必须经中国药品生物制品检定所或者卫生部授权的药品检验所抽样检验;检验合格的,方准进口。
对于经卫生部审核批准的短半衰期放射性核素的药品,在保证安全使用的情况下,可以采取边进口检验,边投入使用的办法。进口检验单位发现药品质量不符合要求时,应当立即通知使用单位停止使用,并报告卫生部和能源部。
第四章放射性药品的包装和运输
第二十条 放射性药品的包装必须安全实用,符合放射性药品质量要求,具有与放射性剂量相适应的防护装置,包装必须分内包装和外包装两部分,外包装必须贴有商标、标签、说明书和放射性药品标志,内包装必须贴有标签。
标签必须注明药品品名、放射性比活度、装量。
说明书除注明前款内容外,还须注明生产单位、批准文号、批号、主要成份、出厂日期、放射性核素半衰期、适应症、用法、用量、禁忌症、有效期和注意事项等。
第二十一条 放射性药品的运输,按国家运输、邮政等部门制订的有关规定执行。
严禁任何单位和个人随身携带放射性药品乘坐公共交通运输工具。
第五章 放射性药品的使用
第二十二条 医疗单位设置核医学科、室(内位素室),必须配备与其医疗任务相适应的并经核医学技术培训的技术人员。非核医学专业技术人员未经培训,不得从事放射性药品使用工作。
第二十三条 医疗单位使用放射性药品,必须符合国家放射性同位素卫生防护管理的有关规定。所在地的省、自治区、直辖市的公安、环保和卫生行政部门,应当根据医疗单位核医疗技术人员的水平、设备条件,核发相应等级的《放射性药品使用许可证》,无许可证的医疗单位不得临床使用放射性药品。
《放射性药品使用许可证》有效期为五年,期满前6个月,医疗单位应当向原发证的行政部门重新提出申请,经审核批准后,换发新证。
第二十四条 持有《放射性药品使用许可证》的医疗单位,在研究配制放射性制剂并进行临床验证前,应当根据放射性药品的特点,提出该制剂的药理、毒性等资料,由省、自治区、直辖市卫生行政部门批准,并报卫生部备案。该制剂只限本单位内使用。
第二十五条 持有《放射性药品使用许可证》的医疗单位,必须负责对使用的放射性药品进行临床质量检验,收集药品不良反应等项工作,并定期向所在地卫生行政部门报告。由省、自治区、直辖市卫生行政部门汇总后报卫生部。
第二十六条 放射性药品使用后的废物(包括患者排出物),必须按国家有关规定妥善处置。
第六章 放射性药品标准和检验
第二十七条 放射性药品的国家标准,由卫生部药典委员会负责制定和修订,报卫生部审批颁发。
第二十八条 放射性药品的检验由中国药品生物制品检定所或者卫生部授权的药品检验所承担。
第七章 附 则
第二十九条 对违反本办法规定的单位或者个人,由县以上卫生行政部门,按照《药品管理法》和有关法规的规定处罚。
第三十条 本办法由卫生部负责解释。
产品名称:REN系列智能化辐射探头
产品描述:REN系列智能化辐射探头均可和REN300、REN300A、REN300B系列主机配套使用,也可以单独配套RenRiArea辐射区域监测软件使用。且具有RS485/RS232的通讯能力。所有探头均可单独外接报警灯,在超阈值的情况下就地给出声光报警。 (一)REN-GM-L型 GM管
产品名称:REN-GM45-Mul型α、β、γ、X多功能射线探头
产品描述:REN系列智能化辐射探头均可和REN300、REN300A、REN300B系列主机配套使用,也可以单独配套RenRiArea辐射区域监测软件使用。且具有RS485/RS232的通讯能力。所有探头均可单独外接报警灯,在超阈值的情况下就地给出声光报警。 1、测量射线类型:α、β、γ、X射线2、探测器:
产品名称:RenRiArea区域辐射监测系统
产品描述:为了加强对放射源和射线装置安全运行的监督管理,保障人体健康、保护环境,根据辐射防护三原则与国家相关标准的要求,考虑人为操作失误、射线装置和放射源意外故障等原因可能引发的放射性危害,有必要建设一套在线xγ射线监测报警系统。 在线式xγ射线监测报警系统通过计算机远程集中监测,完成对放射性
产品名称:REN300+REN-3He-N型固定式中子、伽玛报警仪
产品描述:本报警仪由REN300在线辐射安全报警仪和REN-3He-N中子探头和REN-NaI30伽玛探头组成。该辐射报警装置是采用特殊设计的前置放大电路,具有灵敏度高、操作方便、自动显示、数据存储和超阈值报警等特点,能实时给出x射线、γ射线、中子射线的辐射剂量率。考虑到现场操作、应急快速响应的需要,主机安装
产品名称:铅屏风、铅衣架、电离辐射警示牌、分源防护屏、铅箱、注射器防护套、报警灯
产品描述:单联移动式防护屏风 1、规格尺寸: H×W:1800×900 (mm)2、商品描述: 上部铅有机玻璃的高度为 H×W:240×240 (mm)3、铅当量: 铅玻璃0.5mmPb, 下部分铅当量为0.5mmpb4、外饰材料:碳素钢板喷
产品名称:REN-SN型半导体超高量程射线探头
产品描述:REN系列智能化辐射探头均可和REN300、REN300A、REN300B系列主机配套使用,也可以单独配套RenRiArea辐射区域监测软件使用。且具有RS485/RS232的通讯能力。所有探头均可单独外接报警灯,在超阈值的情况下就地给出声光报警。 1、测量射线类型:X、γ射线2、探测器:半导体探








 沪ICP备09065761号-15
沪ICP备09065761号-15